HPLCの上手な使い方
Ⅱ章-4 緩衡液について
逆相HPLCの溶離液として使用する水には必要に応じて緩衡作用を持たせる場合があります。特にイオン解離性サンプルの分析やイオン対クロマトグラフィーにおいては、この緩衡液が分析を成功させるための最重要な因子であるとも言えます。一般に緩衡液とは、弱酸とその塩が共存している水溶液のことであり、強酸や強塩基を加えてもpHをほとんど変化させない性質を持っています。ここではHPLCで頻繁に使用されるリン酸緩衡液を中心に、調製法や使用上の注意点を説明します。
緩衡液の選択
HPLCの溶離液として緩衡液を使用する場合、さまざまな要因によってその選択が制限されています。以下に緩衡液選択の際の注意点をまとめました。
サンプルの性質
目的サンプルの解離が抑制できるpH範囲の緩衡液を選択してください
分析目的
最終的に分取HPLCが目的であるならば、簡単に除去できる緩衡液を選択してください
使用充填剤
分析カラムに使用されている充填剤がポリマー母体であれば問題ありませんが、シリカゲル母体の充填剤を使用する場合はアルカリ性緩衡液の使用は避けてください
UV検出波長
酢酸やクエン酸等は低波長側で紫外吸収がありますので、200nm付近での分析にはリン酸緩衡液の使用をお薦めします
緩衡液の種類
以下にHPLCで使用される主な緩衡液をまとめました。
酸類
リン酸、酢酸、クエン酸、酒石酸、ホウ酸
塩基類
水酸化ナトリウム、水酸化カリウム、水酸化リチウム、 Tris
塩類
リン酸二水素ナトリウム、リン酸水素二ナトリウム、リン酸ナトリウム、リン酸二水素カリウム、リン酸水素二カリウム、酢酸ナトリウム、炭酸ナトリウム、クエン酸ナトリウム
ジーエルサイエンス先頭へ
緩衡液の調製にあたって
緩衡液は単に弱酸とその塩を混合すればよいというわけではなく、緩衡作用を最大限に発揮するpHに溶液を調整する必要があります。一般に弱酸および弱塩基は、それらのpKa±1の範囲で緩衡能力を持つといわれているため、HPLCで使用する場合も溶離液のpHをできるかぎりpKaに近づけた方が緩衡効果があります。以下に、代表的な緩衡液のpKaと緩衡液組成表を示しますので溶離液調製の参考にしてください。
|
リン酸
|
酢酸
|
クエン酸
|
||||||
|---|---|---|---|---|---|---|---|---|
|
pk1 = 2.15
|
pKa = 4.76
|
pK1 = 3.13
|
||||||
|
pk2 = 7.20
|
A液 : 0.1M CH3COONa
|
pK2 = 4.76
|
||||||
|
pk3 = 12.33
|
B液 : 0.1M CH3COOH
|
A液 : 0.05M クエン酸
+0.2M ホウ酸 |
||||||
|
A液 : 0.2M Na 2HPO 4
|
|
B液 : 0.1M Na3PO4
|
||||||
|
B液 : 0.2M NaH 2PO 4
|
||||||||
|
pH
|
A液
|
B液
|
pH
|
A液
|
B液
|
pH
|
A液
|
B液
|
|
5.8
|
8
|
92
|
3.6
|
7.4
|
92.6
|
2
|
97.5
|
2.5
|
|
6
|
12.3
|
87.7
|
3.8
|
12
|
88
|
3
|
88
|
12
|
|
6.2
|
18.5
|
81.5
|
4
|
18
|
82
|
4
|
77.5
|
22.5
|
|
6.4
|
26.5
|
73.5
|
4.2
|
26.4
|
73.6
|
5
|
67
|
33
|
|
6.6
|
37.5
|
62.5
|
4.4
|
39
|
61
|
6
|
59
|
41
|
|
6.8
|
49
|
51
|
4.6
|
49
|
51
|
7
|
49.5
|
50.5
|
|
7
|
61
|
39
|
4.8
|
60
|
40
|
8
|
42.5
|
57.5
|
|
7.2
|
72
|
28
|
5
|
70.4
|
29.6
|
9
|
34.5
|
65.5
|
|
7.4
|
81
|
19
|
5.2
|
79
|
21
|
10
|
27
|
73
|
|
7.6
|
87
|
13
|
5.4
|
82.4
|
17.6
|
11
|
22
|
78
|
|
7.8
|
91.5
|
8.5
|
5.6
|
90.4
|
9.6
|
12
|
8.5
|
91.5
|
|
8
|
94.7
|
5.3
|
|
※この液は、 Na3PO4の組成が不安定であるため低精度です。
|
||||
|
※ pH<5.8はリン酸で調整してください。
|
||||||||
ここに示した数値はあくまでも参考であり、試薬を溶解する純水の状態や作業環境、さらに厳密に言えば水温までも含むさまざまな要因によって変化する可能性があります。したがって、緩衡液調製の際にはこの組成表にしたがってpH調製した後、必ずpHメーターを用いて微調製を行ってください。なお、pH調製を有機溶媒と混合した後に行うと、その値は見かけ上のpH値であり、実際の溶液中での化学平衡とは無関係であると言われています。したがって、再現性のある溶離液を調製するためには、有機溶媒と混合する前にpH調製を行うよう心がけてください。
緩衡液の濃度について
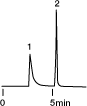
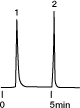
HPLCで緩衡液を使用する場合、その濃度にも注意しなければなりません。以下に、水溶性ビタミンであるチアミンとリボフラビンの分析において緩衡液濃度がクロマトグラムに与える影響を示します。
| Column | 1mM NaH2PO4 | 10mM NaH2PO4 | 100mM NaH2PO4 |
|---|---|---|---|
| 市販ODS |
|
|

|
| Inertsil ODS-2 |

|

|

|
Eluent : CH3CN/1,10,100mM NaH2PO4=12/88
Flow rate: 1.0mL/min
Detector : UV254nm
Sample : 1.Thiamin
2.Riboflavin
この結果のように、性能の劣る充填剤で吸着性のあるサンプルを分析する場合、緩衡液の濃度を高くすればきれいに溶出するようにもなりますが、充填剤自身の寿命の点から考えれば緩衡液濃度はできるだけ薄い方が望ましいといえます。したがって、Inertsil ODS-2のような高性能の充填剤は、緩衡液濃度を抑えて分析できるため、必然的に寿命も長くなります。
緩衡液のpHについて
緩衡液を用いて溶離液を調製するにあたり、その水溶液のpHを適切に調製することは非常に重要です。少しでもpHがずれていると、サンプルによってはまったく保持パターンが異なってしまう場合もあります。その一例として、pH変化による各種サンプルの保持挙動を以下に示します。
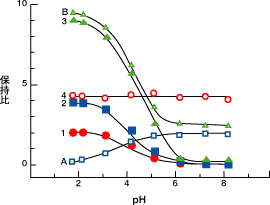
| 《分析条件》 | |
|---|---|
| Column | :Inertsil ODS-2 |
| 4.6x150mmI.D. | |
| Eluent | :CH3CN/buffer=30/70 |
| Flow rate | :1.0mL/min |
| Detector | :UV 254nm |
| Col.Temp. | :40℃ |
| Sample | :1.Benzoic acid |
| 2.o-Toluic acid 3.Dimethyl benzoic acid 4.Acetophenone A.Aniline B.Dimethyl benzoic acid |
Buffer
Sample 1,2,3,4,A:50mM Phosphate buffer
Sample B:50mM Phosphate buffer+5mM TBA
このグラフより、中性サンプルであるアセトフェノンはどのpH域でも同様の保持を示すのに対し、酸性サンプルや塩基性サンプルはpHの変化に伴って保持挙動がまったく異なっていることがわかります。とくにpH3~6付近ではグラフの勾配がきついため、わずかのpH変動でも保持が大きく異なってきます。したがって、このようなイオン解離性サンプルをそのサンプルのpKa付近のpHで分析する場合には、非常に正確なpH調整が必要となります。また、共存するサンプル等に影響がないのであれば、できるだけ保持の安定したpH範囲(pH<3あるいはpH>6)で分析を行うことをお薦めします。しかしながら、酸性化合物は中性領域でイオン解離してしまうためほとんど保持がなく、すべてのサンプル(Sample1~3)が重なって溶出してしまいます。このような現象が起こったときに、サンプルに保持を持たせるために使用する試薬をイオン対試薬といいます。このイオン対試薬については後で詳しく述べますが、中性領域で保持のないサンプルでも、この試薬とイオン対を形成することによって保持を持つようになるため分析が可能となります。グラフ中のBは、溶離液にTBA(テトラブチルアンモニウム)を添加してSample3の分析を行った例ですが、イオン対試薬を使用しない場合と比べ、中性領域の保持に大きな違いがあることがおわかりいただけると思います。





































