固相抽出ガイド

1. 固相抽出法とは
固相抽出法は、1970年代後半に米国において高速液体クロマトグラフィーの理論展開の過程で考案された分析前処理法で、化学結合型シリカ、ポリマーゲルあるいはグラファイトカーボンなどの種々の担体を充填したミニカラムを用いて、試料中の目的物質の抽出・精製を行なっていく手法のことです。
固相抽出法は、簡便で迅速性に優れた抽出法として医学、薬学、化学工業、環境などの各分野で広く利用され、その有用性が立証されています。
また、使用する有機溶媒の量が少ないこともあり、環境に負荷をかけない抽出法として、食品中の残留農薬分析法や水道法、JISなどの各種試験法に採用されています。
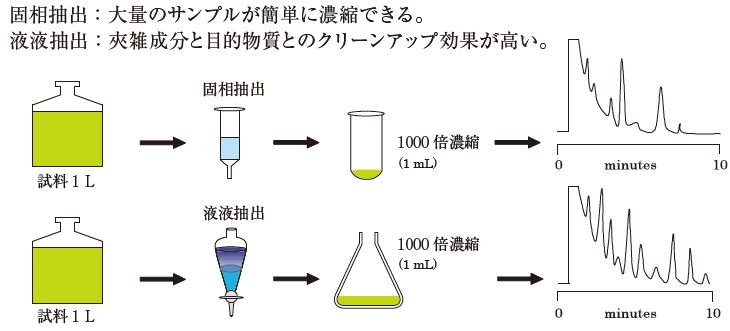
2. 液液抽出法と固相抽出法の比較
液液抽出法と固相抽出法を、操作性の面から比較します。
| 液液抽出法 | 固相抽出法 |
|---|---|
| 使用する有機溶媒が多い | 使用する有機溶媒が少ない |
| 環境への負荷が大きい | 環境への負荷が小さい |
| サンプルによりエマルジョンを形成 | エマルジョンを形成しない |
| 水溶性の高い物質は適用が難しい | 水溶性の高い物質でも適用できる |
| 操作が煩雑で時間がかかる | 簡便で迅速に処理できる |
| 自動化が難しい | 自動化が比較的容易 |
固相抽出の特長を端的に示します。
簡便な操作で高い濃縮効果が得られることから、飲料水、環境水分析で利用されています。
また、食品分析の前処理に固相抽出が採用されているように、適切な固相の選択により目的物質のみを抽出する優れたクリーンアップ効果も期待できます。
3. 固相抽出の手法
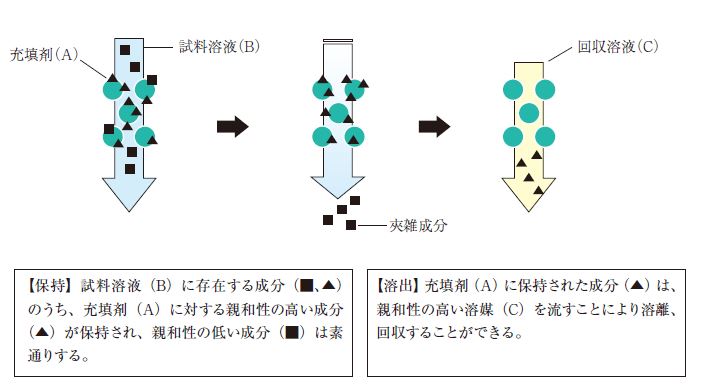
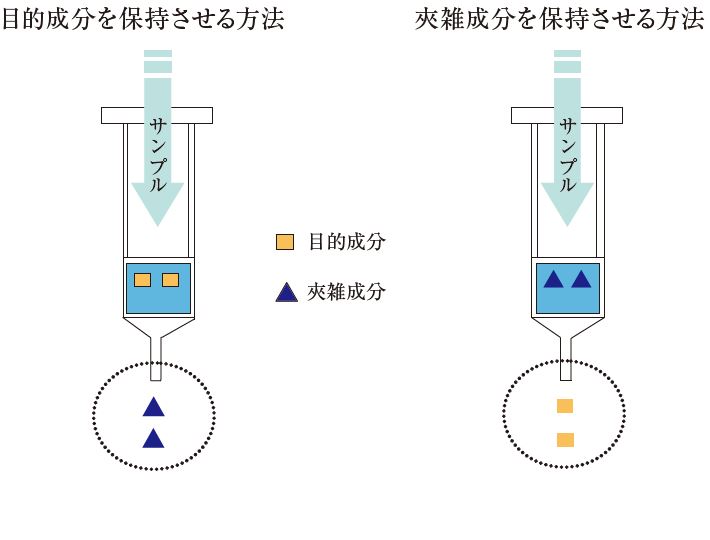
固相抽出は、目的成分を固相に保持させた後、共存している夾雑成分を洗浄のステップで分離・精製しながら目的成分を回収する手法が一般的です。
近年では目的成分を素通りさせ、夾雑成分を固相に保持させる手法も用いられるようになりました。
4. 固相の種類
4-1. 固相分離剤の種類
固相抽出が紹介された当初は、固相分離剤として用いられているものは化学結合型シリカゲルやアルミナなど数種類でしたが、普及に伴い分離特性に優れた固相剤も開発され、現在ではさまざまな分野で多用な使い方ができるよう、バリエーションも豊富になってきています。
| 固相分離材 | 固相分離材の種類 |
|---|---|
| ポリマー | スチレンジビニルベンゼン系(SDB)、ジビニルベンゼン系(DVB)、 メタクリレート |
| シリカゲル | 化学結合型シリカゲル、未修飾シリカゲル |
| ケイ酸マグネシウム | - |
| アルミナ | 酸性アルミナ、中性アルミナ、塩基性アルミナ |
| グラファイトカーボン | - |
| 活性炭 | - |
| セルロース | - |
| ポリアミド | - |
4-2.固相分離剤としてのシリカゲルの特性
固相分離剤として利用されるシリカゲルはきわめて硬いため、膨潤収縮を起こしにくく、化学的にも安定性のある物質です。自然界に広く分布しているため入手しやすく、加工しやすい性質も併せ持っているので、主要な固相分離剤として汎用されています。
固相分離剤に使用するシリカゲルは、微量ですが不純物として金属が含まれています。そのため、対象化合物によっては含有微量金属とキレート錯体を形成することがあります。
| 形状 | 破砕状 |
|---|---|
| 粒子径 | 40~60µm(一部120µmも市販) |
| 細孔径 | 60~80Å(一部150~500Åも市販) |
| 表面積 | 100~550㎡/g |
| 仕様pH | 2~9推奨(短時間であればメソッドによりpH 1~14も可能) |
4-3. シリカゲルを母体とする固相分離剤の分離モード別分類
固相分離剤を分離モード別に分類すると、逆相(無極性相互作用)、イオン交換相、順相(極性相互作用)などの種類に区分できます。なお、シリカゲルベース以外に、順相固相としてケイ酸マグネシウム(フロリジル)およびアルミナ(酸性アルミナ、中性アルミナ、塩基性アルミナ)なども市販されています。
| 逆相 (無極性相互作用) |
イオン交換相 | 順相 (極性相互作用) |
|
| 陰イオン交換 | 陽イオン交換 | ||
| C18 / オクタデシル C8 / オクチル CH / シクロヘキシル PH / フェニル C2 / エチル |
NH2 / アミノプロピル PSA / 1級, 2級アミン SAX / トリメチルアミノプロピル |
CBA / カルボン酸 PRS / プロピルスルホン酸 SCX / ベンゼンスルホン酸 |
CN / シアノプロピル 2OH / ジオール Si / シリカゲル |
4-4. 固相分離剤としてのポリマーの特性
1990年代では、水中のアシュラム、オキシン銅などの農薬の分離濃縮には、C18が使われていました。
しかし、C18を利用した場合は、メーカー間、ロット間のばらつきが指摘されており、適用が難しいとされていました。同様に、抗生物質オキシテトラサイクリン分析においても、C18固相使用時における回収率の不安定さについて指摘がなされていました。
この問題点を解決するために、近年ではスチレンジビニルベンゼン共重合体を充填した固相(ポリマー固相)が使われはじめました。ポリマー固相はその有用性が評価され、現在では公定法にも広く採用されています。
固相分離剤としてのポリマーには、高純度タイプが用いられており、シリカゲルを母体とする固相に見られた微量金属による影響をほとんど受けない性質を持っています。
4-5. ポリマーを母体とする固相分離剤の分離モード別分類
市販されているポリマー固相は、開発当初はスチレンジビニルベンゼン共重合体(SDB)のみでしたが、合成技術の進歩やLC/MS(/MS)分析の広がりとも相まって、高極性化合物に親和性のあるN含有メタクリレートやN-ビニルピロリドンといった官能基を導入した新しい逆相ポリマーが市販されるようになりました。
加えて、疎水性相互作用が極めて弱いメタクリレート型のイオン交換固相や、疎水性相互作用が強く働くイオン交換相(ミックスモード)など、機能性を高めたポリマーも開発されました。現在市販されている、主なポリマー固相を示します。
| 逆相 (無極性相互作用) | イオン交換相(メタクリレート型) | |
| 陰イオン交換 | 陽イオン交換 | |
| PLS-2 / スチレンジビニルベンゼン(SDB) RP-1 / メタクリレート(MA)含有-SDB PLS-3 / N含有MA-SDB Pharma / N含有MA-SDB HLB / N含有-SDB |
MA-1 / 4級アンモニウム含有-MA MA-2 / 3級アミン含有-MA |
MC-1 / スルホン酸含有-MA MC-2 / カルボン酸含有-MA |
| イオン交換相(ミックスモード型) | ||
| 陰イオン交換 | 陽イオン交換 | |
| MAX / 4級アンモニウム含有-SDB WAX / 3級アミン含有-SDB |
MCX / スルホン酸含有-SDB WCX / カルボン酸含有-SDB MPC / スルホン酸+C18-SDB |
|
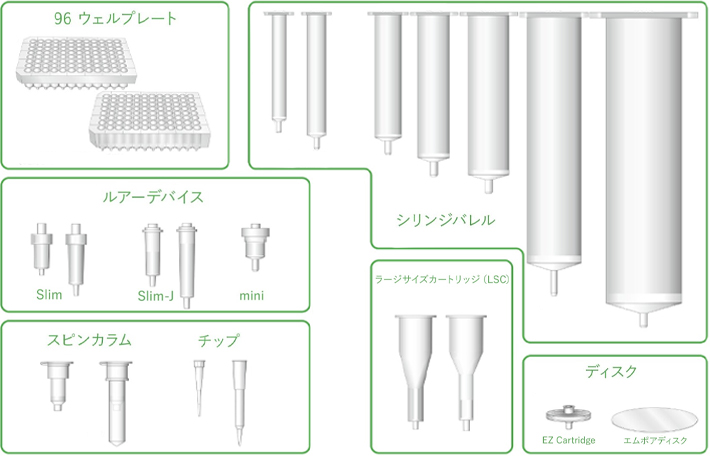
4-6. 市販されている固相抽出製品
汎用されている市販製品としては、以下に示すような形態が、一般的に用いられています。
96穴の標準プレートを採用したハイスループット分析対応の 96ウエル標準プレート固相(96Well SPE Plate)などもあります。
5.固相分離剤の選択性
複雑な組成のサンプルであるほど、選択性に優れた固相を選択することが重要です。なぜなら、固相分離剤の選択性が低いと、夾雑成分の影響により、目的成分の定量性が著しく低下するリスクがあるためです。
このような高マトリックス試料中の分離目的物質を効率的に分離精製するためには、逆相、イオン交換相、極性相ならびに混合相(ミックスモード)の選択性の違いを理解することが大切です。以下に、固相分離剤の選択性の違いについて示します。
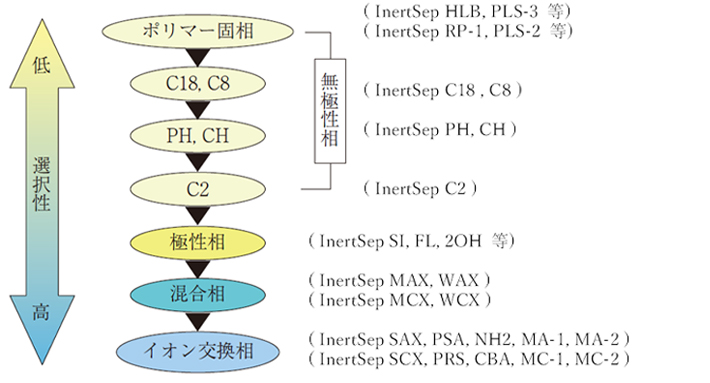
目的分離物質が水中でイオンとして存在する解離性物質であるならば、無極性の非選択性固相分離剤を用いるよりも、はじめから混合相またはイオン交換相を選択したほうが、夾雑成分の影響を最小限に抑えることができ、かつクリーンな抽出物が得られます。
6.固相と分離目的物質との相互作用
分離目的物質が固相に保持されるメカニズムとしては、主に
①無極性相互作用 ②極性相互作用 ③イオン交換相互作用 の3つがあります。
6-1. 逆相固相と無極性相互作用の働き
無極性相互作用の原理を以下に示します。
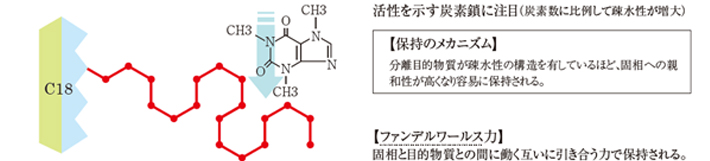
例えばシリカベースの逆相固相として、C2、PH、CH、C8およびC18と炭素数の異なる製品があります。
炭素数が多くなると、固相そのものの疎水性が増大し、さまざまな疎水性物質を保持しようとする性質が強くなります。そのため、分離目的物質とマトリックスの極性がともに低いと、逆相固相との相互作用による選択性も低くなります。
分離目的物質の疎水性が高い場合は、炭素数の少ないC2、PH、CHなどを用いると、マトリックスとの選択的分離が可能です。無極性相互作用は、マトリックスが水系であれば相互作用が強く働き、保持が促進されます。
一方、水系マトリックス中にメタノール、アセトニトリルなどの極性有機溶媒が混在すると、保持が阻害されるので注意が必要です。
6-2. 順相固相が持つ極性相互作用の働き
極性相互作用は、以下に示すように、マトリックスがn -ヘキサンなどの低極性溶媒中において、その作用が増強されます。
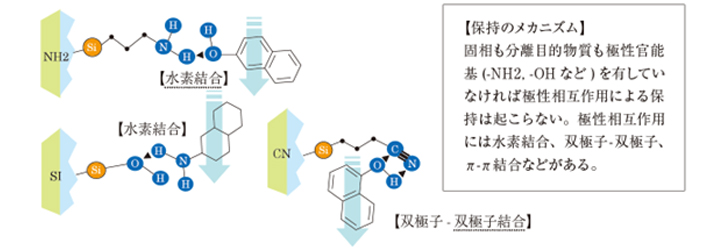
一方、極性溶媒中では分離目的物質が極性物質であっても、また固相の選択が適切であったとしても、極性相互作用は生じません。
保持された分離目的物質を溶出する場合は、極性溶媒を固相に流すことで相互作用が弱まり、目的物質が回収できます。
6-3. イオン交換固相が持つイオン交換相互作用の働き
イオン交換相互作用の原理を以下に示します。
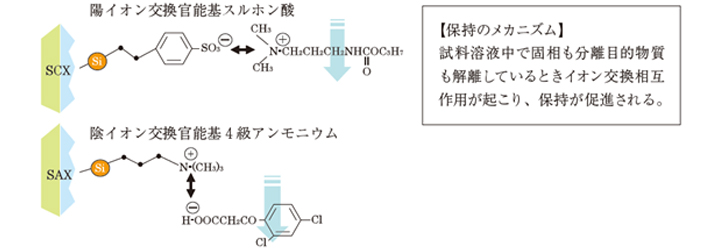
分離目的物質が、ある一定条件下で解離すれば、イオン交換相との間で相互作用が起こります。
イオン交換相互作用は、帯電している目的物質だけを固相に保持させるため、イオン性を有しない夾雑成分の影響を最小限に抑えることができます。
また、マトリックス中に水と混和するメタノールなどが混在していても、目的物質が解離していれば、必ずイオン交換相互作用が起こるため、目的物質は保持されます。
ただし、マトリックス中の塩濃度が高いと相互作用が阻害される可能性が高くなります。
7. 固相カラムの上手な取扱方法
固相カラムの取扱方法としては、以下のように4つの方式があります。
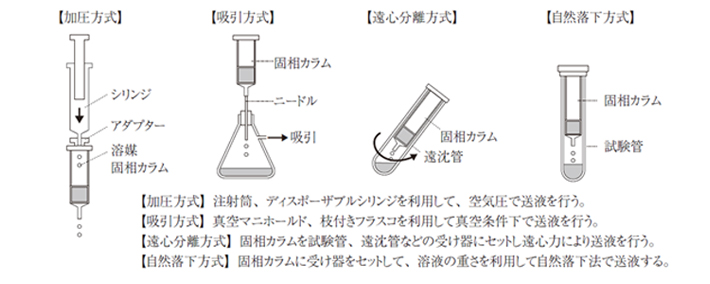
①加圧方式
シリンジを接続して、シリンジから押し出される空気圧を利用した加圧方式は、検体が少ないときや負荷量が少ないときに簡単に操作できるので便利です。
一定の流速で加圧送液できる自動加圧送液装置などは、水質分析で広く使われています。
②吸引方式
吸引方式は、最も一般的な取り扱い方法です。多検体の取り扱いには、専用の吸引マニホールドを利用します。
③遠心分離方式
96 Well SPE Plateタイプ、スピンカラムタイプのような特殊な固相形態において使用されています。
④自然落下方式
自然落下方式は薬物分析、残留農薬分析、カビ毒分析などで広く必要数だけ固相カラムと試験管を用意すれば、各工程の操作を自然落下で行えるので、かかりきりで操作する必要性がなく便利です。
ただし、使用する固相カラムにより、通液性に差があるため、多くの時間が必要になるときがあります。
8. 固相抽出の操作手順
固相抽出の一般的な使い方としては、以下のように4つの手順で使用します。
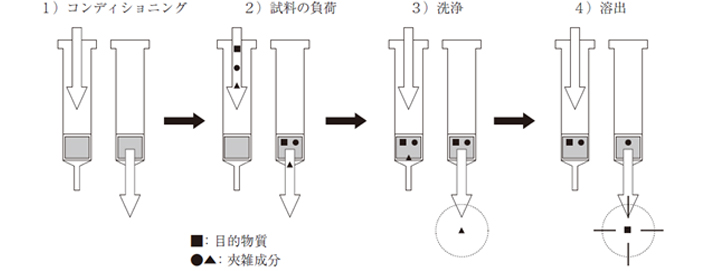
それぞれの手順のガイドラインを、固相の種類ごとに紹介します。
実際し試験される内容に応じて、実験的な確認を実施する事をお薦めします。
8-1. コンディショニング(conditioning/固相の活性化)のガイドライン
分離目的物質と固相が相互作用を起こしやすくなるように、あらかじめ適切な溶液を固相に流します。
| 固相の種類 | コンディショニング条件 |
|---|---|
| 逆相 (ポリマー、C18など) |
①溶出溶媒に酢酸エチル、ジクロロメタンなどを使用するときはまずそれらの溶媒を 1リザーバー容量分を流し、つぎにメタノールを1リザーバー分、流す。 溶出溶媒にメタノールまたはアセトニトリルをベースに用いているときはメタノール またはアセトニトリルを1リザーバー分、流す。 (Sli mおよびSlim-Jなどのルアーデバイス型固相は6 mL流す) ②次に水を同量流して置換する。メタノール、アセトニトリルが固相にわずかでも残 ることにより保持に悪影響を及ぼす場合は倍量流す。 ③微妙な条件で保持させる場合、マトリックスのpH調整に用いた溶液を流し、あらか じめ固相をマトリックスと同じ条件にしておくことにより保持が改善されることがあ る。 ④C18などのシリカゲルベースの固相を用いるとき、微量に含まれる不純物の金属が目 的物質とキレート錯体を形成することがある。このような場合、あらかじめ1 mol/L EDTA溶液を流しておくと防止できる。 ⑤酸性または塩基性物質できわめて保持が弱いような場合、イオンペアー試薬を加え てイオン対を作った上で固相へ流すことがある。 このような場合、保持の効果を上げるために、あらかじめイオンペアー試薬を固相へ 流しておく。 |
| 順相 (SI,FLなど) |
ヘキサンなどの低極性溶媒を1リザーバー容量分流す。 (SlimおよびSlim-Jなどのルアーデバイス型固相は3~6 mL流す) |
| 混合相(ミックスモード) & イオン交換相 |
①メタノールを1リザーバー容量分流す。 (SlimおよびSlim-Jなどのルアーデバイス型固相は3~6 mL流す) ②次に水を同量流して置換する。(CBA,WCX,MC-2については2 %ギ酸を1リザーバー 容量分流した後、水を同量流して置換することがある。) ③必要によりpH 6~7の緩衝液を同量流し、固相をあらかじめマトリックスと同じpHに しておく。 |
8-2. 試料負荷(sample loading/目的物質の保持)のガイドライン
コンディショニングに引き続き、試料液を固相に添加し、目的物質および夾雑成分を固相に保持させます。
試料を溶解している溶液が流れることで、相互作用の弱い夾雑成分は溶解溶液とともに固相から溶出されて除去されます。
| 固相の種類 | 保持の条件 |
|---|---|
| 逆相 (ポリマー、C18など) |
①芳香族エステル類のような中性物質は、固相に対する親和性が高いので、液性の影 響をそれほど受けずに容易に保持する。 ②解離性の酸性または塩基性物質を効率的に保持させるためには、マトリックスのpH を調整して非解離型にしなければならない。 目的物質のpKaがわかっていればそれを参照しながら適正なpHにする。ただし、非解 離型にしたとしても、疎水性の構造を有していなければ保持しない。 ③マトリックス中にメタノール、アセトニトリルおよびアセトンなどの極性溶媒が混 在しているとき、含まれる量により保持を阻害する。例えば、疎水性の目的物質であ ればそれらの溶媒が20%含まれていても保持するかもしれないが、極性物質であれば あるほど保持せずに破過する。 したがって、溶媒の濃度を保持する濃度以下(例えば10 %以下)にするため水または 緩衝液で薄めるか、あるいは減圧濃縮などで有機溶媒を飛ばす必要がある。 ④試料が血清、血漿などのときは、等量または倍量の水もしくはpH緩衝液などで希釈 して固相へ負荷する。 ⑤きわめて水溶性の高い酸性および塩基性物質は、通常の条件ではなかなか保持しにく い。これらを効果的に保持させる方法としてイオンペアー試薬を添加してイオン対を作 った後、流せば保持する。酸性物質は臭化テトラn-ブチルアンモニウムまたは塩化セチ ルトリメチルアンモニウムを、塩基性物質はヘキサンスルホン酸ナトリウムまたはペン タンスルホン酸ナトリウムを用いる。 |
| 順相 (SI,FLなど) |
①構造式中に極性官能基-OH,-NHを有する極性物質に適用するが、マトリックスはn-ヘ キサンなどの低極性溶媒でなければならない。 ②残留農薬分析でSI,FLが広く用いられるが、固相へ負荷するときの溶媒としてアセト ン-n-ヘキサン混液を用いるような場合、アセトンの組成比が5 %を超えると保持が悪 くなる農薬が出てくるので注意が必要である。 ③極性物質の中にはn-ヘキサンなどの低極性溶媒に溶けないものもある。ジクロロメタ ンや酢酸エチルなどの溶ける溶媒にまず溶かした後、順次n-ヘキサンなどの低極性溶媒 と混和しながら極性を下げ固相へ負荷する。 |
| 混合相(ミックスモード) & イオン交換相 |
①固相も目的物質の双方とも解離していることが保持の絶対条件である。それぞれの pKaの値を確認し、正しい使用を実施する。 ②固相と目的物質の組み合わせが適切でないと、固相に目的物質が保持しない、ある いは、強固に保持しすぎて溶出困難になるなどの現象が起こり得る。 |
8-3. 洗浄(washing/夾雑成分の除去)のガイドライン
試料の負荷に引き続き、洗浄液を流し、目的物質は固相に保持させた状態で、相互作用の弱い夾雑成分を完全に溶出除去します。このとき、相互作用の強い夾雑成分は、目的物質と同様に固相に保持されたままである可能性が高いと考えられます。
このような場合は、洗浄溶液を変えて、別途2段階洗浄を検討すると良いでしょう。
| 固相の種類 | 洗浄の条件 |
|---|---|
| 逆相 (ポリマー、C18など) |
①1~2リザーバーの水で洗浄し、高極性の夾雑成分を洗い落とす。 (Slim、Slim-Jおよびminiなどのルアーデバイス型固相は3~6 mLで洗浄) ②水洗浄の際、保持している目的物質が一部漏れ出るときは、マトリックスと同様の pH条件である緩衝液または薄めた酸、アルカリなどで洗浄する。 ③夾雑成分の多い試料を流したときは水だけでは夾雑成分は洗い落とせない。 5~30%程度の濃度のメタノールを1リザーバー分流し、残っている夾雑成分を極力 洗い出す。このときの適切な濃度は保持している目的物質によって異なるので実験的 に確認する。 ④保持している目的物質がn-ヘキサンまたは酢酸エチルなどに溶けなければそれらを 洗浄溶媒として使える。 ただし、固相に残っている水を3分程度吸引して除いた後に流す。 |
| 順相 (SI,FLなど) |
①n-ヘキサンなどの低極性溶媒を1~2リザーバー容量分流して洗浄する。 (SlimおよびSlim-Jなどのルアーデバイス型固相は3~6 mLで洗浄) ②洗浄効果を高めるためn-ヘキサンに極性溶媒(アセトンなど)を適量混合した混液 で洗浄する。 |
| 混合相(ミックスモード) & イオン交換相 |
①水で洗浄する。 ②100%メタノールで洗浄する。(イオン交換相互作用が弱い場合は50 %メタノール で洗浄) |
8-4. 溶出(Elution/目的成分の回収)のガイドライン
溶出液を流量調節しながら流し、固相に保持された目的物質を固相床から溶離し、あらかじめ用意した受け器(試験管、濃縮管、フラスコなど)に回収します。目的物質より相互作用の強い夾雑成分は固相に残るので、目的成分だけを選択的に回収することも可能になります。
| 固相の種類 | 溶出の条件 |
|---|---|
| 逆相 (ポリマー、C18など) |
①食品分析および薬物分析ではメタノールまたはアセトニトリルを用いる。溶出量は カラムサイズおよび固相の種類によるが、ポリマー固相であれば30 mg/1 mLで最少 0.2 mL, 270 mg/6mL で5-10 mL程度、シリカゲルベースの逆相固相であれば 100 mg/1 mL で最少0.5 mL、500 mg/3 mL で3-5mLが一般的な溶出量となる。 ②シリカゲルベースから塩基性物質を溶出するとき、回収率がなかなか上がらない場 合がある。 これは残存シラノールの吸着影響が考えられる。2~4 %濃アンモニア水含有メタノー ルを用いて溶出すると劇的に改善することがある。 ③目的物質の溶解性によりn-ヘキサン、トルエン、酢酸エチルおよびジクロロメタン などが溶出溶媒として用いられる。ただし、溶出前に固相を脱水しないと固相中の残 存水が溶出液に混入する。 |
| 順相 (SI,FLなど) |
①アセトン、メタノールなどの極性溶媒で溶出する。 ②溶出条件をより選択的に設定したい場合は、ヘキサン、酢酸エチルなどにアセトン またはメタノールを適量添加した混液を用いる。 |
| 混合相(ミックスモード) & イオン交換相 |
【溶出液を濃縮乾固して塩が残存すると分析に影響する場合】 ①弱陽イオン交換固相は10~20 mmol/L 塩酸-メタノールまたは2~4 %濃アンモニア 水含有メタノールを用いる。 ②強陽イオン交換固相は2~4 %濃アンモニア水含有メタノールを用いる。 ③陰イオン交換固相に保持させた-COOHを有する酸性物質を溶出するときは 10~20mmol/L塩酸-メタノールまたは2~4 %濃アンモニア水含有メタノールを用いる。 ⑤弱陰イオン交換固相に保持させた[SO3-]を有する強酸性物質は2~4 %濃アンモニア 水含有メタノールを用いる。 【溶出液を濃縮乾固して塩が残存しても分析等に影響が無い場合】 ①強陽イオン交換固相に保持させた塩基性物質の溶出は、0.5 mol/L 以上の塩化アン モニウム溶液、酢酸アンモニウム溶液、ギ酸アンモニウム溶液または塩化カリウム溶 液、リン酸一カリウム溶液などを用いる。 溶解補助剤としてメタノールまたはアセ トニトリルを用い、それらの混液を用いる。 ②陰イオン交換固相から-COOHを有する酸性物質の溶出は0.07~1.0%リン酸-メタノー ル混液、0.5 mol/L 以上の塩化アンモニウム-アセトニトリルまたは0.5 mol/L 以上の クエン酸-メタノールを用いる。 ④弱陰イオン交換固相に保持させた[SO3-]を有する強酸性物質は0.5 mol/L 以上の塩 化アンモニウム-メタノールまたは塩化アンモニウム-アセトニトリルを用いる。 |





































